19世紀の終わり、Coley 氏が、がん患者を、溶血性連鎖球菌(溶連菌)に強制感染させるという、かなり乱暴ながん治療を試みました。激甚な急性感染症にかかると、がんが消失し再発しない患者がいることは従来から知られていたからです。そこで、毒性の強い菌を感染させれば、免疫が刺激され、結果的に、活性化された免疫システムががんを殺すと考えたのです。実際に、がん治療としての効果が出たケースもあったそうですが、当然ながら、感染症で亡くなる方が続出しました。
この治療は、もちろん、中止されましたが、「免疫を強く刺激すれば、がんを叩ける」 という、がん治療の重要な方向性を示しました。今日でも、「コーリーの毒」という名前で知られており、免疫学においては、「ウィリアム・B・コーリー賞」というものが、今なお存在します。
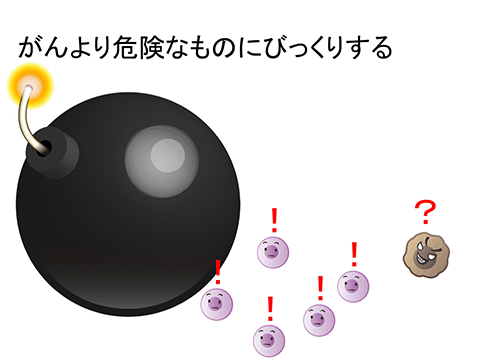
更に、「免疫療法でがんを攻撃するのに、がん特有の抗原は必要ではない」 ことも示しました。「がんを殺せる程、免疫を強く刺激するものは、そもそも生命にとって危険なもの」 、
患者さんの体内に、菌でも毒でも、何らかの免疫刺激物を投与する方法を取る限り、効果と安全性のジレンマから逃れられないという、体内投与の限界が、19 世紀末、既に示されていたのです。
「コーリーの毒」より安全なものを求める研究が繰り返しなされました。
あるいは、「丸山ワクチン」というものも開発されました。丸山ワクチンは、元気な人には感染できない弱い菌(結核菌)を更に弱毒化し、菌体の一部を精製したものです。ほぼ副作用がない安全なものですが、その代償として治療強度は落ちてしまいます。他にも、数々の免疫療法が試されてきましたが、効果と副作用は常に裏腹の関係で、発熱などの免疫副反応がほとんど出ないような刺激の弱いものは、がんに対する治療強度として十分とはいえません。そこで、免疫抑制の及ばない、体の外に、一度、免疫細胞を取り出し、活性化してから体内に戻す免疫細胞療法が開発されました。「ワクチンには、ウイルスの特異抗原は必要ない」、「何か、他のウイルスに感染させればいい」 。こうして、実際にウイルスや菌を感染させる生ワクチンが実用化されました。
ワクチンにおいては、生ワクチンに代わって、感染力を叩いたウイルスを投与する不活化ワクチン、更に安全性を追及し、ウイルス粒子の一部だけを投与するもの、合成されたペプチドを投与するものと、常に、安全性を求めた「改良」が行われてきました。結果は、感染防止効果は落ち続け、生ワクチン以外は、殆ど、実効的な感染防止効果がありません。
感染防止効果生ワクチン > 不活化ワクチン > 分画化ワクチン(蛋白等) > ペプチドワクチン
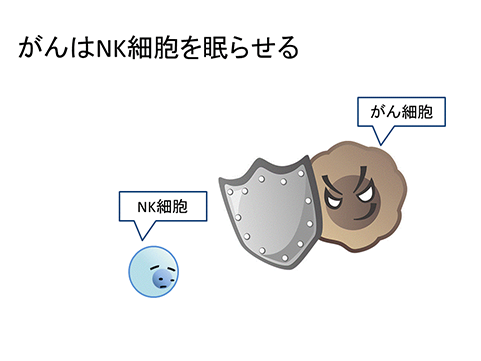
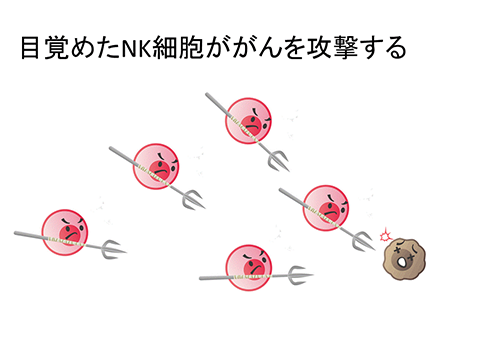
「強く刺激されることで、がんを殺した」正体は、1970年代に、ようやく、はっきりしました。リンパ球の中に、がん細胞を混ぜると、即座に殺してしまう細胞が存在することが分かったのです。ナチュラルキラー(NK)細胞の、事実上の発見です。NK細胞は、T細胞などの獲得免疫系の細胞と異なり、初めて遭遇する相手であっても、がん細胞であれば、その場で、直ちに攻撃し、殺してしまうことが分かりました。
当然、NK細胞を刺激して、がんを治すことを誰もが考えますが、溶血性連鎖球菌の一件と同様のジレンマがたちはだかります。
1980年代に入り、NK細胞を活性化・増殖させるインターロイキン2(IL-2)というサイトカイン(細胞間情報伝達物質)の一種が、遺伝子工学の手法を用いて、大量に使える様になりました。米国政府も、がんの克服を国の重要方針として掲げておりましたので、IL-2の活用によるがん治療に巨額の予算をつけます。
免疫細胞療法は、米国政府研究機関NIHが基礎を確立しました。LAK療法の開発が本格化したのは1984年のことです。リーダーのローゼンバーグ博士は、外科医であり、免疫の専門家ではありませんでした。
米国の手法は、「生き物」である細胞に対して、強引に強い刺激を加えたものです。抗がん剤が奏効しないがん患者さん数百人に1回、実施するだけで、全員に何らかの効果がみられました。腫瘍の大きさが半減以下の効果を示したケースは15~25%、更に、腫瘍が消失し、再発しない人もいました。明確な有効性の証明 = エビデンスを確立しましたが、非現実的なコストがかかるため、実用化は見送られました。
それでも、米国LAK療法は、免疫細胞療法の基礎を築きました。巨額の資金を投入した大掛かりで組織的な研究により、免疫細胞療法において使用される機材、容器などの資材、薬剤、などを医薬品・医療グレードとして使用可能であることを検証し、安全管理の考え方やシステムなども確立しました。こうしたビッグサイエンスの基盤があって初めて、今日の免疫細胞療法を薬事法に準じたレベルの安全管理体制で実施することが可能なのです。
米国政府研究機関の巨大プロジェクトの成果があってこそ、研究段階・初期開発段階をクリアし、応用開発の段階へ突入できました。その主役は京都大学の研究者が担います。
1985年、京都大学にいた勅使河原計介医学博士(当社創業者、代表取締役会長)は、米国ダートマス大学に移動します。IL-2レセプターβサブユニットの発見者でもある勅使河原医学博士は、免疫の専門家として、永年、細胞培養を手掛けてきた実績がありました。NIHのグループは、勅使河原医学博士に、「NK細胞の活性を高め、高活性を維持しながら、NK細胞だけを選択的に増殖できれば、がん治療は変わるのだが、NK細胞は培養が難しい」 高いハードルについて悩みを打ち明けました。彼らのやり方、単純な刺激を強引に押し付ける培養法では、無理があると考えていた勅使河原医学博士は、帰国後、大久保祐司医師と共同で、複雑な培養技術を組み合わせ駆使することでNIHが突破できなかった壁を乗り越えます。NK細胞の活性をNIH法よりも更に高めながら、かつ、健常人であれば1000倍以上増殖させることに成功し、ANK療法(Amplified Natural Killer Therapy)と名付けました。
日本では、米国法を極端にスケールダウンし、注射器で20~50ml程度の採血から培養をスタートする一般的な免疫細胞療法が普及し、LAK療法は当初言われたほどの効果がない、という風評が広がってしまいました。今日でも、各地で実施されています。様々なブランド名で呼ばれていても、ほとんどの免疫細胞療法は、20~50ml採血、2週間培養(血液バッグに入れて静置するだけです)、点滴してもほとんど免疫反応がない、とほぼ同じパターンです。
ANK療法では、5~8リットルもの血液を体外循環させ、大量に分離したリンパ球の中から、NK細胞だけを選択的に増殖させます。1クールとして、米国法よりもNK細胞数、NK活性ともに上回る戦力を整えるのが基本です。これを一度に体内に戻すと、大きな腫瘍が壊死を起こして危険であると想定され、週2回を原則に、12回に分割投与することで、強い治療強度と、安全性の両立を実現します。
ANK療法は、1993年に基本型が完成し、小規模な臨床試験を経て、2001年に一般診療を開始しています。